Hai kawan-kawan, selamat berjumpa kembali, semoga selalu dalam keadaan sehat dan berada dalam lindungan Allah, admin akan memberikan contoh soal pilihan ganda Redok dan Elektrokimia dilengkapi dengan jawaban dan pembahasan. Semoga contoh soal pilihan ganda Redok dan Elektrokimia dilengkapi dengan jawaban dan pembahasan ini bermanfaat banyak.
Soal No. 1). Suatu unsur transisi memiliki konfigurasi elektron sebagai berikut :
1s22s22p63s23p63d54s2
Tingkat oksidasi tertinggi dari unsur tersebut adalah ….
A. +7 D. +3
B. +5 E. +2
C. +4
Jawaban : A
Penyelesaian :
Elektron terluar menentukan jumlah bilangan oksidasi.
Soal No. 2). Reaksi berikut yang merupakan redoks adalah ….
A. AgNO3 + NaCl AgCl + NaNO3
B. Cl2 + SO2 + H2O HCl + H2SO4
C. MgO + H2O Cu2 + H2O
D. CuO + 2H Cu2 + H2O
E. SO3 + KOH K2SO4 + H2O
Jawaban : B
Penyelesaian :
Karena dalam reaksi tersebut mengalami reaksi reduksi dan oksidasi.
Soal No. 3). Suatu reaksi redoks :
aBr2 (aq) + bOH- (aq) cBrO3- (aq) + dBr- (aq) + eH2O (l)
Harga a, b, c dan a berturut-turut agar reaksi di atas setara adalah ….
A. 3, 6, 1, 5, 3 D. 6, 1, 3, 5, 3
B. 3, 6, 5, 1, 3 E. 1, 5, 3, 6, 3
C. 6, 1, 5, 3, 3
Jawaban : A
Penyelesaian :
3Br2 (aq) + 6OH- (aq) 1BrO3- (aq) + 5Br- (aq) + 3H2O (l)
Soal No. 4). Pada persamaan oksidasi reduksi berikut (belum setara),
KMnO4(aq) + KI(aq) + H2SO4 MnSO4(aq) + I2 aq) + K2SO4(aq) + H2O(l)
Bilangan oksidasi Mn berubah dari ….
A. +14 menjadi +8 D. -1 menjadi +2
B. +7 menjadi +2 E. -2 menjadi +2
C. +7 menjadi -4
Jawaban : B
Penyelesaian :
KMnO4 = B.O K = +1
B.O Mn = x
B.O O = -2
1 + x – 8 = O x = +7
MnSO4 = Mn B.O = +2
Soal No. 5). Pada reaksi :
4HCl (aq) + 2S2O3-2 (aq) 2S (s) + 2SO2 (g) + 2H2O (l) + 4Cl- (aq)
bilangan oksidasi S berubah dari ….
A. +2 menjadi 0 dan +4 D. +5 menjadi +2 dan 0
B. +3 menjadi 0 dan +4 E. +6 menjadi -2 dan +4
C. +4 menjadi 0 dan +2
Jawaban : A
Soal No. 6). Bilangan oksidasi klor dalam senyawa natrium hipoklorit, kalium klorit dan kalium klorat berturut-turut adalah ….
A. +3 +5 +7 D. -1 +3 +5
B. +1 +5 +7 E. -1 +1 +3
C. +1 +3 +5
Jawaban : C
Penyelesaian :
Natrium hipoklorit, Kalium klorit, Kalium klorat.
Soal No. 7). Setarakan reaksi berikut menggunakan metode setengah reaksi! (suasana basa)
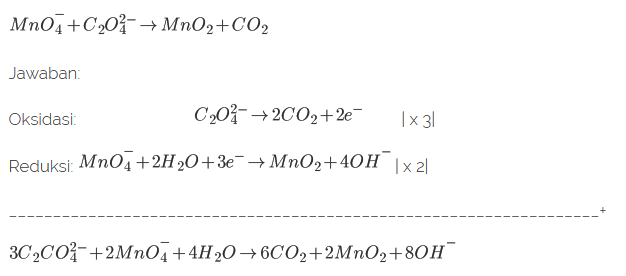
Soal No. 8). Diketahui beberapa persamaan reaksi berikut:
1. C2O42− → 2CO2 + 2e;
2. Al3+ + 3e → Al;
3. Pb2+ + 2e → Pb; dan
4. Ca → Ca2+ + 2e.
Persamaan reaksi reduksi ditunjukkan pada nomor ….
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Persamaan reaksi di atas adalah setengah reaksi. Untuk menentukan jenis reaksi reduksi atau oksidasi pada setengah reaksi, cukup dengan memperhatikan letak elektron.
• Jika letak elektron di ruas kiri maka jenis reaksinya adalah reduksi (penangkapan elektron).
• Jika letak elektron di ruas kanan maka jenis reaksinya adalah oksidasi (pelepasan elektron).
Jadi, persamaan reaksi reduksi ditunjukkan oleh nomor 2 dan 3 (C).
Jawaban: C
ijin copas ya buat referensi soal , mksh