Berikut ini adalah 10 soal dalam bentuk essay mengenai kesetimbangan kimia yang sudah dilengkapi dengan jawaban serta pembahasannya. Okay, mudah-mudahan contoh soal essay dan jawaban kesetimbangan kimia ini bermanfaat banyak.
Pengertian kesetimbangan kimia adalah keadaan reaksi bergantian di mana laju reaksi reaktan dan produk adalah sama dan konsentrasi keduanya tetap. Keseimbangan kimia hanya terjadi dalam reaksi bolak-balik di mana laju pembentukan reaktan sama dengan laju pembentukan suatu produk. Reaksi akan terjadi terus menerus secara mikroskopis sehingga disebut keseimbangan dinamis.
Soal No. 1). Saat kesetimbangan terdapat 0,5 mol dari awalnya 2 mol, sehingga A yang bereaksi adalah 1,5 mol. Gunakan untuk menentukan mol-mol yang lain saat kesetimbangan.
Jawaban:

Soal No. 2). N2O4 adalah gas tidak berwarna hampir sedangkan NO2 adalah berwarna coklat tua. Bagaimana untuk menentukan apakah sistem berikut berada di ekuilibrium?N2O4(g) → 2NO2(g)
Jawaban:
Reaksi : N2O4(g) -> 2NO2(g)
Tak berwarna coklat
Bila sejumlah gas N2O4 dimasukkan ke dalam botol tertutup, gas yang semula tak berwarna secara perlahan-lahan akan berubah menjadi coklat. Pada suatu saat warna tersebut akan tidak bertambah pakat, tetapi secara bertahap akan menjadi semakin coklat.
Pada suatu saat warna tersebut akan tidak bertambah pekat, pada saat itulah terjadi kesetimbangan. Pada saat setimbang tersebut masih ada gas N2O4. Hal ini dapat dibuktikan dengan mendinginkan tabung tersebut. Pada saat didinginkan warna coklat semakin pucat, ini menunjukkan bahwa gas NO2 terbentuk lebih banyak.
Soal No. 3). Kesetimbangan Kimia digambarkan sebagai proses yang dinamis, namun hal ini ditandai oleh sifat makroskopik konstan. Bagaimana bisa demikian?
Jawaban:
Bersifat dinamis artinya secara mikroskopis reaksi berlangsung terus menerus dalam dua arah dengan laju reaksi pembentukan sama dengan laju reaksi peruraian. Pada kondisi setimbang, laju reaksi ke kanan sama dengan ke kiri, sehingga selalu konstan.
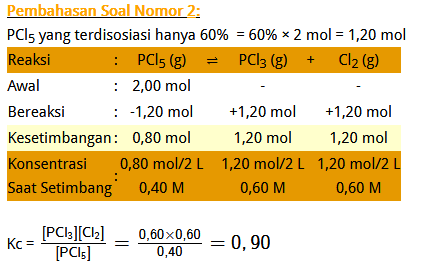
Soal No. 4). 2 mol PCl5 dimasukkan ke dalam wadah 2 L dan dipanasi pada suhu 250 °C untuk mencapai keadaan setimbang, ketika 60% PCl5 terurai menjadai PCl3 dan Cl2. Nilai tetapan kesetimbangan, Kc, untuk reaksi PCl5 (g) ⇌ PCl3 (g) + Cl2 (g) adalah …
Jawaban:
Soal No. 5). Dalam kesetimbangan: A (g) + B (g) ⇌ C (g) + D (g)
Ketika 1 mol masing-masing reaktan dicampur, terbentuk 0,6 mol setiap produk, berapakah nilai tetapan kesetimbangan reaksi tersebut jika volume wadah tertutup adalah 1 L?
Jawaban:
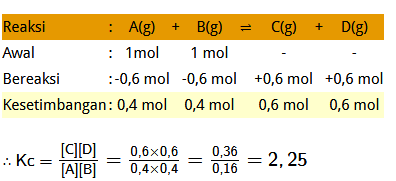
Soal No. 6). Diketahui entalpi pembentukan C2H5OH(l) = -278 kJ/mol ; CO2(g) = – 393,5 kJ/mol dan H2O(l) = -286 kJ/mol. Pembakaran 100 gram alkohol (C2H5OH) menghasilkan kalor sebanyak …. (Ar H = 1 ; C = 12 ; O = 16)
Jawaban :
C2H5OH(l) + 3O2(g) ………..> 2CO2(g) + 3H2O(l)
ΔH = ΔHof produk – ΔHof reaktan
= ( (2 (- 393,5 kJ/mol) + 3(- 286 kJ/mol)) – ( 1(-278 kJ/mol) + 3(0))
ΔH = – 1376 kJ/mol
ΔH = Q/n
Mol = Massa/Mr
= 100 g/46 g mol-1
= 2,17391
Q = ΔH x n
= – 1367 kJ/mol x 2,17391 mol
= – 2972 kJ
Soal No. 7). Reaksi berlangsung 3 kali lebih cepat dari semula setiap kenaikan suhu 100C. Jika pada suhu 400C suatu reaksi berlangsung 3 menit, maka pada suhu 700C reaksi akan berlangsung selama..
Jawaban :
Rumus :
t2 =1/3 ΔT/T t1
t2 = 1/3 (30/10) x 3 menit
t2 = 1/9 menit
Soal No. 8). Suatu reaksi dengan V = K (A)2 (B) jika konsentrasi A dan B diperbesar 4 kali maka V reaksi menjadi…. Semula
Jawaban :
V1 = V2
K (A)2 (B) = K (4A)2 (4B)
(A)2 (B) = 16 (A)2 (4B)
V2 = 64 kali V1
Soal No. 9). Sebanyak 6 mol NH3 dipanaskan hingga menjadi N2 dan H2. Pada saat kesetimbangan tercapai tersisa 2 mol NH3 . Jika tekanan total campuran gas adalah 10 atm makan tentukanlah harga Kp.
Jawaban:

Soal No. 10). Volum akhir pada saat setimbang tercatat 25 ml (diukur pada P dan T yang sama). Volum gas NH3 yang terjadi pada saat setimbang adalah…
Jawaban:
