Selamat berjumpa kembali kawan-kawan, admin akan mencoba memberikan 5 Contoh Soal Essay Lengkap Jawaban Pembahasan Larutan Penyangga. Semoga saja Contoh Soal Essay Lengkap Jawaban Pembahasan Larutan Penyangga ini bermanfaat banyak.
Larutan penyangga memiliki ciri saat ditambah sedikit air atau sedikit basa atau sedikit asam nilai pH relatif tetap, jika terjadi perubahan relatif kecil. Larutan penyangga atau buffer / dapar adalah larutan yang dapat mempertahankan pada pH tertentu.
Soal No. 1). Dicampurkan dua larutan yaitu 50 mL NaOH 0,1 M dan 50 mL CH3COOH 0,2 M. Tentukan apakah campuran tersebut membentuk larutan penyangga atau tidak!
Jawaban:
Pembahasan
-Tentukan dulu jumlah mol masing-masing dengan mengalikan volume dan molaritasnya:
50 mL NaOH 0,1 M
Jumlah mol = 50 x 0,1 = 5 mmol
50 mL CH3COOH 0,2 M
Jumlah mol = 50 x 0,2 = 10 mmol
-Setelah tahu molnya, cek reaksinya apakah ada sisa asam lemahnya atau sisa CH3COOH
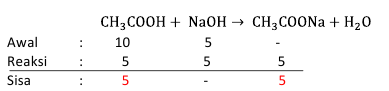
Terdapat sisa CH3COOH sebanyak 5 mmol, berarti campuran tersebut membentuk suatu larutan penyangga.
Soal No. 2). 0,15 mol asam asetat (CH3COOH, Ka = 2 × 10 − 5) dan 0,10 mol NaOH dilarutkan dalam air sehingga diperoleh larutan penyangga dengan volume 1 liter. Tentukan pH larutan penyangga tersebut!
Jawaban:
Pembahasan
Data:
0,15 mol CH3COOH direaksikan dengan 0,10 mol NaOH
Reaksi yang terjadi:

Soal No. 3). Diberikan campuran dari beberapa larutan sebagai berikut:
1. 200 mL CH3COOH 0,1 M dan 200 mL NaOH 0,1 M
2. 200 mL CH3COOH 0,2 M dan 200 mL NaOH 0,1 M
3. 200 mL NH4OH 0,1 M dan 200 mL HCl 0,1 M
4. 200 mL NH4OH 0,1 M dan 200 mL HCl 0,05 M
Campuran yang membentuk larutan penyangga adalah…
Jawaban:

Kita bisa lihat bahwa yang memiliki sisa adalah reaksi nomor 2 dan 4. Jadi, yang membentuk larutan penyangga adalah nomor 2 dan 4.
Soal No. 4). Tentukanlah perbandingan antara volume asam propionat 0.2 M (Ka = 2 x 10^-5) dengan natrium propionat 0.1 M untuk menghasilkan larutan penyangga dengan pH = 5!
Jawaban:
Pembahasan:
Jika.pH larutan = 5 maka konsentrasi H+ = 1 x 10^-5.
Rumus untuk mencari konsentrasi H+ penyangga asam adalah sebagai berikut:
H+ = Ka x (mol AL / mol garam)
AL = asam propionat
Garam = natrium propionat
H+ = Ka x (mol AL / mol garam)
1 x 10^-5 = 2 x 10^-5 x ( mol AL/mol G)
Mol AL / mol G = 1: 2
M x V AL / M x V G = 1: 2
0.2 x V AL / 0.1 x V G = 1: 2
V AL : V G = 1: 4
Soal No. 5). Tentukan pH larutan jika 800 ml larutan CH3COOH 0,1M dicampur dengan 400ml larutan CH3COONa 0,1M (Ka CH3COOH = 1,8×10-5) !
Jawaban:
Pembahasan: mol CH3COOH = 800 x 0,1 = 80 mmol
mol CH3COONa = 400 x 0,1 = 40 mmol
[ H+ ] = Ka .na/nbk
= 1,8 x 10-5 x( 80/40)
= 3,6 x 10 -5
pH = -log 3,6 x 10 -5
= 5 – log 3,2